极性分子和非极性分子的判断方法 如何辨别
2023-09-30 09:18:34文/王莹判断极性分子和非极性分子的方法是双原子的单质分子都是非极性分子,例如氢气,氧气。双原子的化合物分子都是极性分子,如HCl,一氧化碳等。多原子分子的极性和非极性具体要看其空间构型是否对称,对称的就是非极性分子。

怎么判断极性分子和非极性分子
(1)双原子分子:取决于成键原子之间的共价键是否有极性。
A-B型分子(HCl ):异核双原子分子都是极性分子;A-A型分子(Cl2):同核双原子分子是非极性分子
同核多原子分子也有非极性分子,如:P4,C60、S8 、B12,特别注意:O3(V型)是极性分子。
(2)多原子分子(ABm型):取决于分子的空间构型和共价键的极性。
化合价法:当中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子;否则为极性分子。
物理模型法:共价键看作作用力,不同共价键看作不等的作用力,根据力的合成与分解,看中心原子受力是否平衡,如平衡则为非极性分子;否则为极性分子。
例:CO2直线型,两个C=O键对称,键极性互相抵消(F合=0),H2O折线型,两个O-H键的极性不能抵消(F合≠0)。
极性分子和非极性分子的概念
分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的、不对称的,这样的分子为极性分子。以极性键结合的双原子分子一定为极性分子,极性键结合的多原子分子视结构情况而定,如CH4就不是极性分子。
非极性分子是指偶极矩μ=0的分子,即原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子。分子中各键全部为非极性键时,分子是非极性的(O3除外)。当一个分子中各个键完全相同,都为极性键,但分子的构型是对称的,则分子是非极性的。
 极性分子和非极性分子的概念
极性分子和非极性分子的概念分子中正负电荷中心不重合,从整个分子来看,电荷的分...
2021-01-14 原子团是什么意思 化学式怎么写
原子团是什么意思 化学式怎么写原子团的意思:两种或两种以上元素的原子结合而成的原...
2023-09-29 高中怎样能学好化学 有哪些方法及技巧
高中怎样能学好化学 有哪些方法及技巧高中生要想学好高中化学,提高自己的化学成绩,首先要...
2023-09-29 高中化学学习方法 如何提高成绩
高中化学学习方法 如何提高成绩高中化学的学习中依然有需要记忆的内容(高中化学兼具...
2023-09-29 高中化学学习方法 有什么窍门
高中化学学习方法 有什么窍门高中化学的全面学习,这其实也是很多同学的学习短板,...
2023-09-29 高中化学怎么学才能学好 有什么学习方法
高中化学怎么学才能学好 有什么学习方法学好高中化学,最简单的方法就是背诵,背诵化学元素符...
2023-09-29 108个化学元素表背诵口诀 简单好记的顺口溜
108个化学元素表背诵口诀 简单好记的顺口溜化学元素千千万万,我们在课本上学到的只是冰山一角,...
2023-09-28 日本第二轮核污水排海什么时候排放 对中国危害多大
日本第二轮核污水排海什么时候排放 对中国危害多大到今天(24日)为止,日本政府和东京电力公司强行启...
2023-09-24 元素周期表字母符号读音顺口溜 有什么速记方法
元素周期表字母符号读音顺口溜 有什么速记方法化学用语是化学学习的基本工具,可以说不学好化学用语...
2023-09-24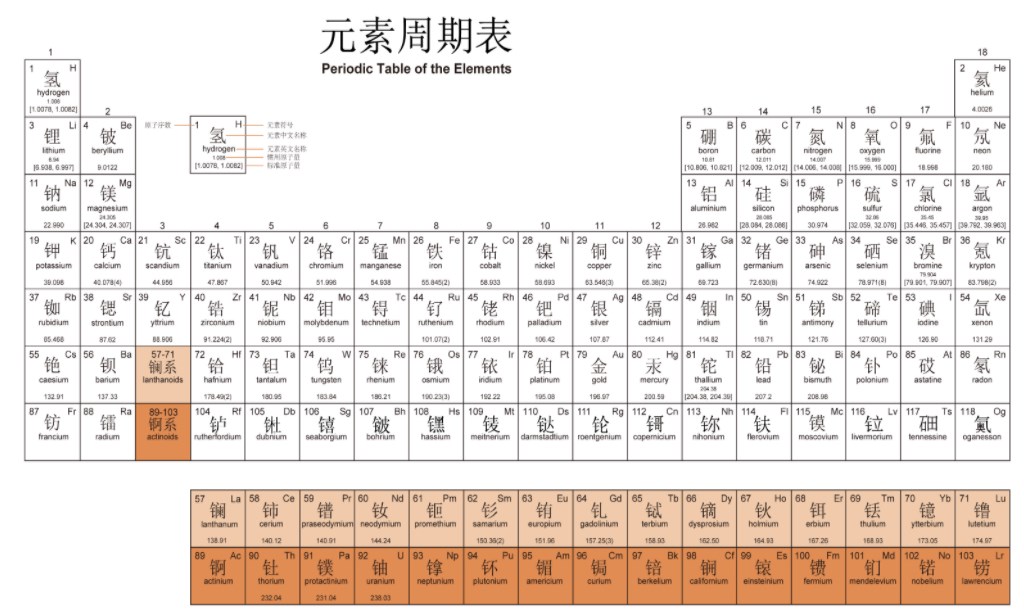 化学元素周期表高清图 有哪些记忆口诀
化学元素周期表高清图 有哪些记忆口诀元素周期表一共118个元素。化学元素周期表是根据原...
2023-09-24 初中必背化学元素36个顺口溜 怎么记忆简单
初中必背化学元素36个顺口溜 怎么记忆简单初中必背化学元素36个顺口溜:氢氦锂镀硼、碳氮氧氟...
2023-09-22 元素符号记忆顺口溜 好记的口诀
元素符号记忆顺口溜 好记的口诀要学好化学就要记好元素符号,而元素符号相对于化学用...
2023-09-21 稀盐酸和铜反应吗
稀盐酸和铜反应吗纯铜肯定不会和稀盐酸反应,倒是可以和浓硝酸反应,至...
2023-09-19 甲烷与氯气反应的化学方程式
甲烷与氯气反应的化学方程式甲烷与氯气反应的化学方程式为:CH4+Cl2=光照...
2023-09-19 用盐酸除铁锈的化学方程式
用盐酸除铁锈的化学方程式用盐酸除铁锈的化学方程式为6HCl+Fe2O3=2...
2023-09-17
点击查看 高中化学 更多内容









